医疗器械如何构建体系文件
1、医疗器械从立项开始到结束,总共需要经历六个阶段,下面依次展开每个阶段需要形成的体系文件。

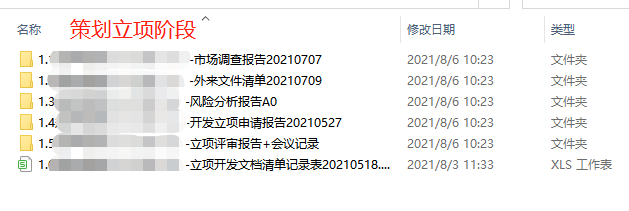
2、策划立项阶段需要的文件:市场调查报告、外来文件清单、风险分析报告A0、开发立项申请报告、立项评审报告+会议记录。
3、设计输入阶段需要的文件:新产品开发计划书、产品规格需求说明书、产品技术要求、整机设计方案、硬件概要说明、机械概要说明、软件需求说明、软件概要说明、软件风险管理报告、软件配置管理计划、软件开发计划、软件改进计划、软件维护计划、软件测试计划、风险管理报告A1、设计输入评审报告。

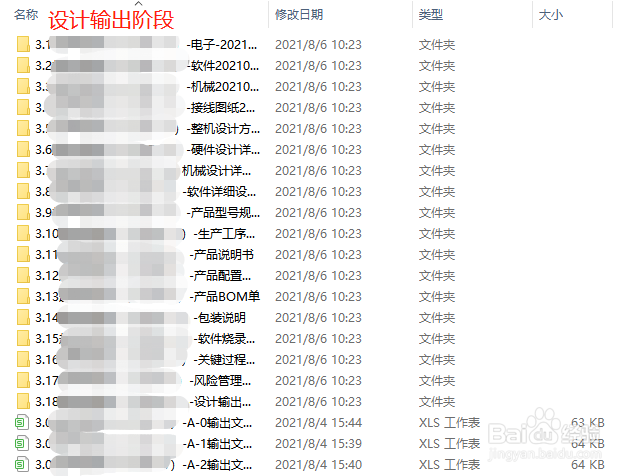
4、设计输出阶段需要的文件:设计输出阶段除了电子、软件和机械需要的图纸和软硬件资料外,还需要有:整机设计方案详细说明、硬件滤鲇魍童设计详细说明、机械设计详细说明、软件详细设计说明、产品型号规格说明、生产工序流程图、产品说明书、产品配置清单、产品BOM单、包装说明、软件烧录代码记录表、关键过程和特殊过程说明、风险管理报告A2、设计输出评审报告。
5、设计验证阶段:物料采购记录表、嚼但匙噻首样检验记录清单、来料检验作业指导书、软件整体测试方案及测试报告、软件(关键)过弛贾班隧程确认报告、线材焊接过程验证报告、整机测试报告、螺丝扭力测试工艺规程确认报告、EMC报告、老化测试(特殊)过程确认报告、包装验证报告、有源医疗器械使用期限分析报告、风险管理报告A3、样机设计验证评审报告。

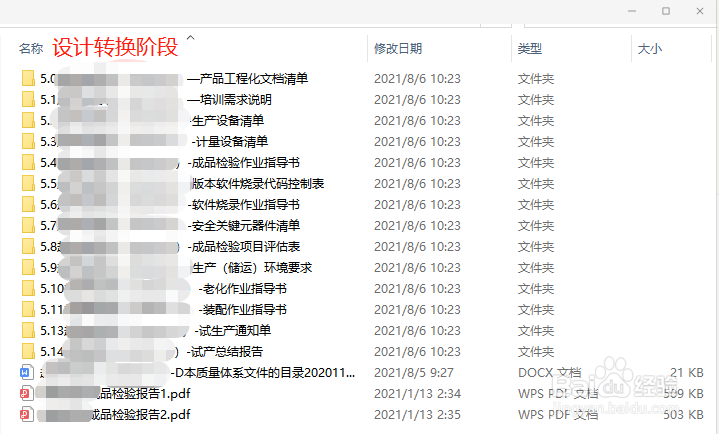
6、设计转换阶段:产品工程化文档清单、培训需求说明、生产设备清单、计量设备清单、成品检验作业指导书、版本软件烧录代码控制表、软件烧录作业指导书、安全关键元器件清单、成品检验项目评估表、生产(储运)环境要求、老化作业指导书、装配作业指导书、试生产通知单、试产总结报告。
7、项目确认阶段:项目确认评审报告、会议记录验证评审。
